值得注意的是,食品和药物管理局(FDA)拥有正式的数据完整性指南,在我们发言时已全面生效。但是,已经遵循现行良好生产规范(cGMP)的公司无需担心。
当然,所讨论文件的标题“药物CGMP的数据完整性和合规性”已经可以明确证明这一点。它还在某种程度上将cGMP规范化为自己的准则,但最好是在反应过度之前考虑首字母缩写所代表的含义,并实现良好的制造规范,因为这一概念才有意义。同时,在这种情况下,数据完整性只是cGMP的副产品,但在当今这个时代,实现数据完整性同样至关重要,甚至不那么重要。
数据完整性和安全性
例如,如今,如何遵守通用数据保护条例或GDPR一直是欧盟公司任务清单中经常出现的项目。在互联网时代,客户数据的安全性变得越来越重要,而数据安全性和完整性是密不可分的。
对于FDA定义不明确的数据完整性,是“数据的完整性,一致性和准确性”。为了实现完整性,数据应遵循ALCOA助记符设备的归属,清晰,同时记录,原始和准确的原则。根据官方的指导原则,遵守所有(如果不是全部的话)应该是彻头彻尾的逻辑。
例如:
- 人员应经过培训,以防止和发现数据缺失
- 检测到的每个质量问题都必须进行正式处理
- 只有授权人员才能访问更改记录
- 每个用户都应拥有自己的(而不是共享的)登录凭据
- 允许使用电子签名代替手写签名
良好生产规范的好处
那么,如果这些准则已经结合任何自尊公司的适当操作程序而已经到位,那么为什么要完全使用它们呢?
最好将标准和法规设为正式。在像制药这样的行业中,逃避规则可能对消费者造成严重后果,因此更加需求标准和法规的普及。
实际上,cGMP的整个概念源于无法及时将致命的,受污染的药片从市场上撤出,直到1940年造成数百人受伤/死亡。如今,FDA可使用多种工具来预防此类灾难再次发生:随机检查,官方警告和缉获毒品。可以说,最有效的工具毕竟是要开始制定数据完整性准则,因为它们是预防性的,而不是被动的。
遵守法规
遵守cGMP意味着将大量资源投入到运营中。例如,必须维护适当的质量管理体系和程序,只有合格且受过充分训练的员工才能留在船上,并且必须使用可靠的测试设施和经过校准的设备。所有这些先决条件的共同点在于,它们已成为表征认真对待保持长期成功的企业的特征。
尽管数据完整性的抽象概念与药物本身相去甚远,但它与产品质量之间存在直接关系。同时,数据完整性和产品缺陷之间不仅存在间接关系,而且数据完整性和产品成本之间也存在间接关系。
因此,其实,FDA基本不会要求公司做任何事情。毕竟,cGMP只是想提醒公司,他们的系统必须保持最新的最新技术。一般而言,任何公司都可以合理地通过。
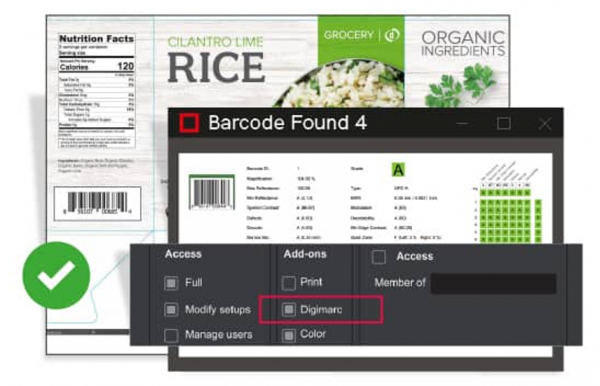
Global Digimagc的质量保证工具直接集成在我们的平台上,将通过简化所有条形码检查来帮助我们的客户加快生产过程,” GlobalVision创始人兼首席执行官Reuben Malz说。
集成至关重要,因为现在可以及时发现打印Digimarc条形码时发生的任何错误,从而为印前客户节省金钱和时间。
Digimarc首席执行官布鲁斯·戴维斯(Bruce Davis)表示:“将Digimarc Verify集成到GlobalVision中不仅帮助运营商节省时间,而且确保其客户的包装质量,同时也使Digimarc条码在行业中得到进一步采用。”
运行Digimarc检查
要在GlobalVision的条形码检查模式下运行Digimarc检查,用户首先需要将其电子印前文件或打印的样本加载到软件中,然后选择Digimarc Inspection模式。 然后,该软件将进行检查以确定是否确实存在Digimarc条形码,并确保增强的分离值匹配或相似。 完成后,将生成一份全面的检查报告,(如果有)其中包含Digimarc和线性条形码检查的结果。 然后,用户可以保存报告并与客户共享以供批准,从而使他们可以更快,更放心地签名审核,Digimarc Verify for GlobalVision是条形码检查模式的附加工具。